
释义 预混与共处理药用辅料 Pre-mixed or Co-processed excipient
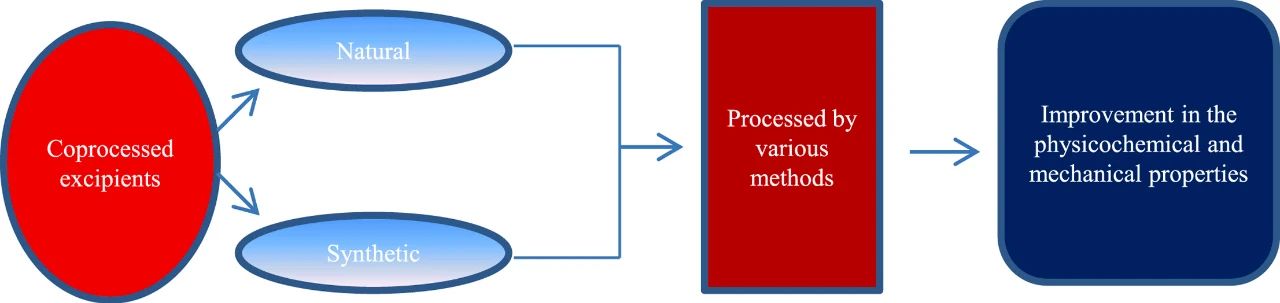
预混与共处理药用辅料系将两种或两种以上药用辅料按特定的配比和工艺制成具有一定功能的混合物,作为一个辅料整体在制剂中使用。既保持每种单一辅料的化学性质,又不改变其安全性。根据处理方式的不同,分为预混辅料与共处理辅料。
预混辅料(Pre-mixed excipient)系指两种或两种以上药用辅料通过简单物理混合制成的、具有一定功能的且表观均一的混合辅料。预混辅料中各组分仍保持独立的化学实体。
共处理辅料(Co-processed excipient)系由两种或两种以上药用辅料经特定的物理加工工艺(如喷雾干燥、制粒等)处理制得,以达到特定功能的混合辅料。共处理辅料在加工过程中不应形成新的化学共价键。与预混辅料的区别在于,共处理辅料无法通过简单的物理混合方式制备。
随着众多新型药物制剂的诞生,其多变的理化性质以及对稳定性的要求;新的设备和生产工艺的出现;新的法规对稳定性、安全性的要求;对辅料的功能提出了更多、更高的标准,使得现有的一些单一辅料已经不能满足发展要求。

预混
预混辅料是由多种单一辅料经特定的加工工艺混合而成,各生产企业的配方组成及加工工艺各不相同,相应的质量标准也是不同的。但目前同类预混辅料的通用名称大多相同。如市场上广泛应用的薄膜包衣预混剂,国内外有多家企业生产,各自拥有不同的配方,由于名称相同,许多使用单位将其认定为相同品种,用相同的质量标准去衡量。但预混辅料并不是几种单一辅料的简单任意混合,这个过程仍然是复杂的,因为每种辅料都可能和其他辅料发生相互作用。它是经过专业的技术人员不断地探索和研究,如同新药开发一样,需要大量的处方筛选,寻找各种性能适合的单一辅料,不断地调整辅料之间的比例,每一步还需要通过严格的性能测试,稳定性考察,同时还要考虑其与各种活性药物的兼容性,最终获得一个满足技术要求的完善的配方。
对于药品研发人员来说,直接使用预混辅料,不仅可以赋予制剂产品许多新的功能,还可以省略掉相当一部分的处方筛选工作。我们只需要了解某一种预混辅料的特点,并适当的加以运用,就可达到原来使用多种辅料反复调配才能达到的效果,大大地缩短了研发周期。
对于生产厂家来说,原来多种辅料反复地采购,质量检验,储存等大量的工作,都被单一的预混辅料代替,大大提高了生产效率,降低了生产成本。
如今传统的片剂采用蔗糖包衣的方法基本退出市场。薄膜包衣预混剂由成膜材料、增塑剂、填充剂和色素等构成,外观上是颜色一致的均匀粉末,进行片剂包衣时比蔗糖包衣简单方便,并降低了片剂的质量和体积。预混包衣辅料中加入其他合适的辅料,可以增强防潮、改善外观、掩盖药物不良气味、调整口感等各种性能,并可以满足药物肠溶、胃溶或者控释要求。

由于高速压片机的出现和直接压片方法的使用,对辅料功能的要求也与日俱增。协同加工在开发具有多功能活性的稳定药用辅料方面起着重要作用。人们对一种或两种天然或合成聚合物的组合进行了广泛的探索,以开发新型稳定的共处理药用辅料。预混与共处理药用辅料是在传统辅料基础上开发制得的新型辅料,具开发周期短、生产简便、具特定功能性且质量稳定等特点,有着较好的应用前景。
1986年FMC公司申请了第一个微晶纤维素与碳酸钙共处理辅料,共处理辅料(Co-processed excipient)的概念被首次提出。此后多家国际著名药用辅料生产商开始研究和开发预混与共处理药用辅料。目前,多种共处理辅料已被成功开发并应用于多种药物制剂的生产中,如法国Roquette公司的甘露醇淀粉复合物(Pearlitol Flash),德国Meggle公司的纤维素乳糖80(Cellactose 80),德国BASF公司的乳糖、聚维酮和交聚维酮直压共处理辅料(Ludipress)、德国JRS公司的硅化微晶纤维素(Prosolv)系列和美国FMC公司的微晶纤维素-羧甲纤维素钠(Avicel RC/CL)等。随着国内药物制剂研发水平的提升,对制剂工艺及新型辅料的需求不断提高,近年来国内辅料企业也着力于共处理药用辅料的研制。
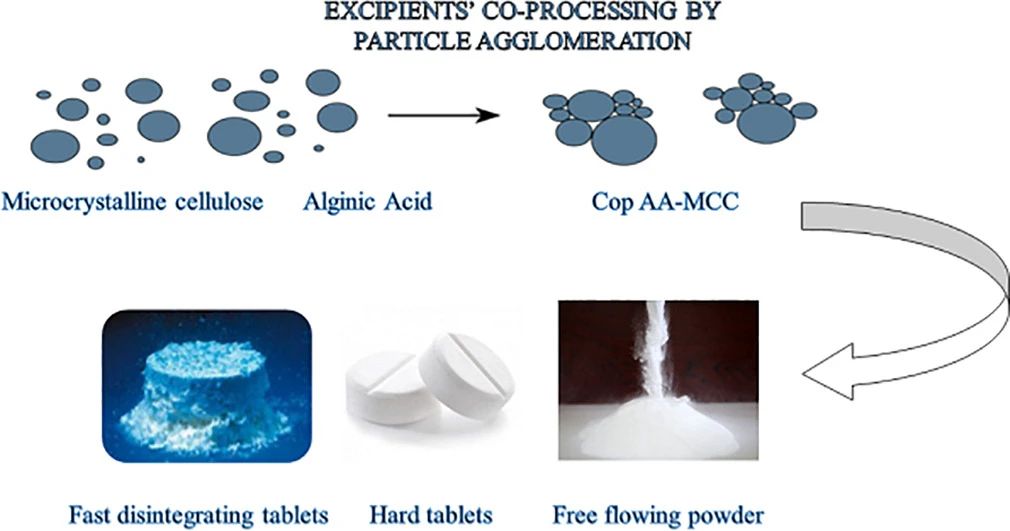
1. 共处理辅料的制备方法
一、喷雾干燥
与单个辅料或其物理混合物相比,喷雾干燥制备的复合辅料流动性、吸湿性、可压性等性能有明显改善,其颗粒性质可控,易于规模化生产,是制备高功能辅料应用最为广泛且较为成熟的一项技术。药物溶液或混悬液均匀喷雾于热的干燥室内,随着液滴表面积和温度的升高,液滴中的水分迅速蒸发,形成可用于直接压片的半球形中空粒子。操作过程中应精确控制各种喷雾干燥工艺参数,如入口空气温度、雾化空气压力、进料速率和固体进料的体积等,这对于颗粒所需性能设计至关重要。将辅料溶液或混悬液喷雾于干燥室内,随着液滴表面积和温度升高,液滴中水分迅速蒸发,形成球状颗粒。入口空气温度、雾化空气压力、进料速率和体积等工艺参数相对重要,喷雾干燥制备的混合辅料流动性、吸湿性、可压性等性能有明显改善,是应用最为广泛且成熟的一项技术。
二、流化床制粒
流化床制粒主要通过气流使辅料保持流化状态,再将辅料溶液或混悬液由上部向流化室内喷入,使粉末聚结成颗粒。通过该方法形成的颗粒形状与喷雾干燥基本一致,其主要区别在于前者颗粒流动性较差,且粒度分布较不规则。
三、干法制粒/湿法制粒
干法制粒是将辅料混合后,靠压缩力制成胚片,再经整粒或过筛至合适的粒径。湿法制粒是将辅料混合后制成软材,再经整粒或过筛至合适的粒径。与喷雾干燥或流化床法相比,该法制得的颗粒流动性较差,孔隙率较小,但可压性往往更佳。
四、共沉淀技术
共沉淀通常是将塑性和弹性辅料溶解于挥发性溶剂中,在65~700℃下用磁力搅拌器搅拌至溶剂完全蒸发,最后将所得湿的凝聚物过筛、干燥。该方法可明显改善辅料的可压性和流动性。应用共沉淀技术开发的直接压片辅料甲壳素和二氧化硅复合物,电镜扫描显示,壳多糖微粒涂覆于二氧化硅内部使两者紧密的整合在一起。该复合辅料可压性和稀释性良好,其高吸湿性和高渗透性使其崩解性也极大的改善。
尽管共处理辅料的优势已被证实,制药业的部分人士仍然不愿意接受共处理,部分原因是他们在不知情的情况下认为使用共处理辅料会增加监管风险,而且监管当局会要求进行额外的安全测试。共处理赋形剂已经存在多年了。1985年,Ludipress® (BASF)是最早为口服固体制剂设计的赋形剂之一。硅化微晶纤维素是在1996年推出的。在过去的25年里,共同加工的材料和等级的数量已经大大增加。
在某些情况下,使用共同加工的辅料提高了成品的坚固性,减少了产品失败的发生率。例如,在一种可压缩性差的散装活性物质(API)的片剂配方中,每一批都必须检查是否有损坏的片剂,而损坏的、被拒绝的片剂数量约为15-20%。使用由配方中已有的辅料组成的辅助加工辅料,通过提高配方的密实度,消除了受损片剂。然后,制造商能够取消人工检查,从而降低成本。更重要的是,该配方和工艺更加稳定。营养品领域也有这样的例子,使用共同加工的辅料使高剂量、难压实的营养补充剂的片剂配方更加坚固,使用的辅料量更少,从而使患者更容易获得小片剂。
随着人们对连续生产药品成品的兴趣增加--特别是口服固体制剂--已经开始限制成分的数量,因为在任何时候可以进入连续生产设备列车的辅料数量有限。在我看来,这反过来又导致了过度简化的配方的增加。
如果在开发连续生产的产品和工艺时没有充分考虑到配方和工艺的稳健性,那么连续生产的好处就可能无法实现,因为满足规格的故障增加。在一个特定的制造列车中,对材料进料斗数量的限制可能是有问题的;它限制了在任何一个时间内可以进入设备列车的材料数量。
一个解决方案?包括一个预混合的步骤,这将允许额外的进料系统。然而,这意味着至少要集成一个额外的单元工艺和相关的喂料器。这将增加资本和开发成本。
对于口服固体制剂的连续生产线,一个替代方案是使用共同加工的赋形剂,如填充剂和超级分解剂的共同加工组合,或填充剂、超级分解剂和压实增强剂的组合。这将需要较少的药物产品生产过程中的材料进料器,从而使生产设备列车更简单。目前有一些等级的共处理辅料,包括这样的材料组合,可供制药和营养品使用。
有些人认为,根据2005年的新辅料非临床测试指南,FDA将要求对共处理辅料进行额外的安全测试,因为有可能形成新的共价化合物。这是不正确的! 使用一系列的分析技术可以证明不存在新的共价键材料。Tobyn等人(1998年)对硅化的微晶纤维素证明了这一点。这种一般方法可以根据需要进行调整,并用于其他共处理辅料,以证明共处理后没有新的共价键实体。反过来,这将允许与共处理赋形剂中的成分赋形剂的安全数据和/或安全使用历史相衔接,这将节省大量费用和时间。
在欧洲出现了另一个监管问题。一些监管者认为,共同加工规避了现行的良好生产规范(cGMPs)。可以说,这种想法与欧洲的法规相悖。欧洲假药指令(FMD)将辅料纳入欧洲药品法规的管辖范围,并包括一项要求,即药品制造商对适用于其辅料生产的良好生产规范的适当性进行正式的风险评估。关于正式风险评估程序的指南已于2015年发布。因此,辅料使用者必须评估辅料生产商对GMP的应用,以确定所应用的GMP标准是否适合于辅料的预期用途。这些监管机构的态度似乎暗示辅料的GMP不如成品的GMP。事实并非如此。全球公认的GMP标准适用于辅料(例如,见ANSI 363,WHO附件5和EXCiPACT)。
举个例子来解释这个矛盾,考虑一下通过直接压缩制成的片剂,包括药物、填充剂(如微晶纤维素)和润滑剂(如硬脂酸镁)。(这与上面关于过度简化的例子相似。)只要销售申请可以接受,没有理由不批准这种制剂上市。然后考虑一种片剂配方,也是通过直接压缩制成的,包括一种药物、一种共同加工的填充物(如硅化微晶纤维素)和一种润滑剂(如硬脂酸镁)。不知何故,根据那些某些监管机构的想法,这种配方不应该被批准,因为它含有一种共同加工的赋形剂,那些监管机构认为这种赋形剂的生产标准低于cGMP标准。制造硅化微晶纤维素的辅料制造商也制造微晶纤维素,而且很可能按照相同的GMP标准生产这两种辅料。那么,为什么微晶纤维素在这种应用中可以被接受,而硅化微晶纤维素却不能?
总之,共同加工的辅料在提高医药产品和工艺的稳健性方面有着巨大的潜力。此外,它们还有可能促进医药成品更稳健和更简单的连续生产。然而,要实现这一潜力,制药商和监管当局都必须接受共处理辅料不会带来不必要的监管风险,并且是辅料武器库中的合法补充。共处理赋形剂的开发者和制造商将需要进行必要的研究,以证明共处理赋形剂在特定应用范围内是安全、有效和稳定的。
应用案例一:
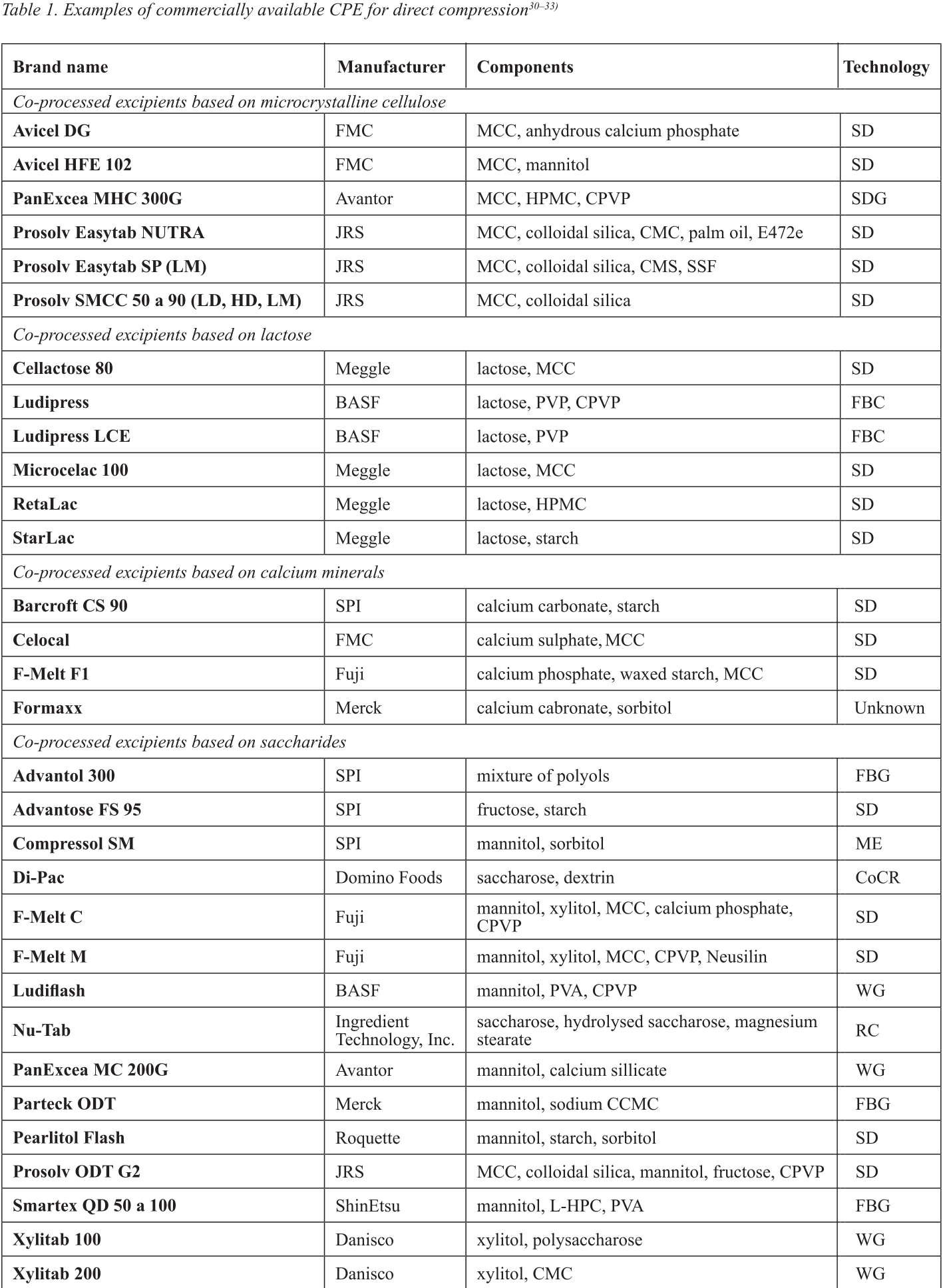
用于直接压片的共处理辅料(CPE)

片剂是最经常使用的剂型。它们的优势在于可获得性、易于服用、稳定性好和价格低廉。生产片剂最简单的技术是直接压片,尽管使用这种方法需要克服许多障碍,主要涉及内容的均匀性和质量的变化、崩解、溶出和片剂的径向硬度。
含有填充剂、粘合剂、崩解剂、润滑剂和其他辅料的共同加工混合物的 '共同加工辅料 '如今被越来越广泛地使用。这些混合物是通过各种技术制造的,主要是通过喷雾干燥、流化床造粒、湿法造粒、熔融造粒、干法造粒和共结晶等。
用于直接压片的共处理药用辅料
应用案例二:
共处理辅料类型对含有卡托普利、曲马多和多潘立酮的口崩片(ODTs)性能的影响
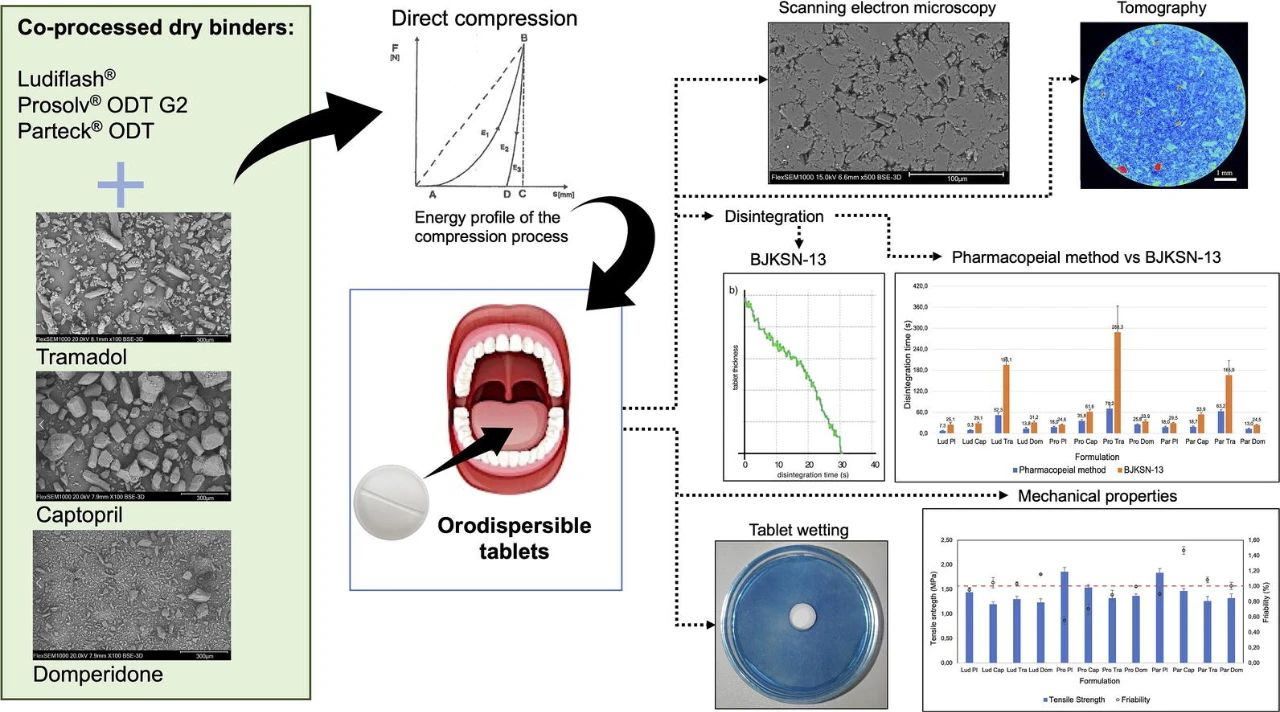
口服分散片(ODTs)的一个重要特点是给药方便,在某些情况下,起效更快,稳定性保持,剂量精确。这项工作的重点是通过直接压片法制备含有甘露醇基辅料Prosolv® ODT G2、Ludiflash®和Parteck® ODT与曲马多、卡托普利和多潘立酮组合的ODT。
亮点
• 利用共处理辅料成功制备了口服分散片。
• Prosolv® ODT G2为所研究的API提供了高质量的口服分散片。
• 通过Ph.Eur.方法和BJKSN-13仪器得到不同的崩解时间。
Prosolv® ODT G2由于含有微晶纤维素而显示出高的塑性变形能量。Parteck® ODT由于含有颗粒状的甘露醇而提供了紧凑的片剂。所有药物都降低了拉伸强度,增加了易碎性,延长了崩解时间,并降低了片剂的孔隙率。含有Prosolv® ODT G2与卡托普利、多潘立酮和曲马多;以及Parteck® ODT与多潘立酮的片剂符合ODTs的生产要求,即易碎性≤1%,崩解时间≤180秒,润湿时间快,吸水率高,抗张强度足够。崩解时间用药典方法和BJKSN-13仪器进行了测试。结果表明,这些方法之间存在着明显的差异,用BJKSN-13仪器测试时,崩解时间更长。
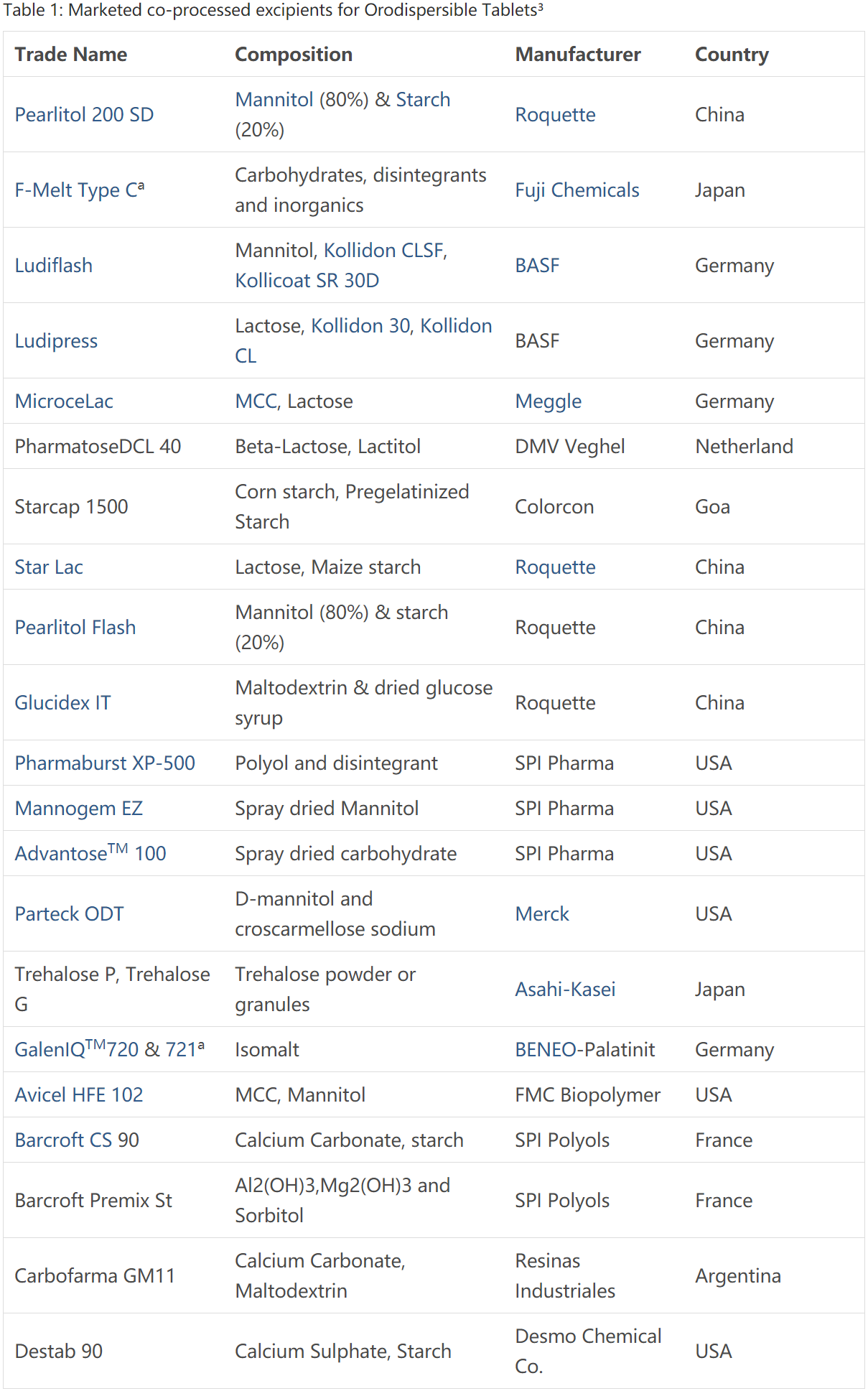
口崩片中应用的已上市共处理药用辅料
2015年12月31日,欧洲药典新章节草案“预混辅料”在27.4中公布,在拟定的章节中,预混辅料定义为“两种或更多种辅料通过物理预混获得的混合物,其中不含有分子键”。用于预混的单个辅料必须符合欧洲药典中相应的各论要求,以及药用物质的通论要求。另外,预混辅料还要符合药用物质通论的要求。预混辅料可以通过只会发生物理反应的工艺过程制得,例如,共同干燥,喷雾干燥,制粒,挤出和高剪切分散。这些工艺可以是间歇生产也可以是连续工艺。所拟的各论包括部分为属性、鉴别、测试、含量、标签和功能性相关特性。在“测试”部分提议“为最终预混物料整体质量定义质量标准”,“如果预混辅料包括了单成分各论中未受控的杂质,则必须指明并进行适当控制”。
2019年7月26日,国家药典委员会拟制定《预混与共处理药用辅料质量控制指导原则》,并收载于《中国药典》四部。该指导原则的发布弥补了我国对预混与共处理药用辅料在法规层面和技术层面的空白,也充分体现出市场对新型药用辅料研发应用的迫切需求。
指导原则:
预混与共处理药用辅料(以下简称产品)及其各组分应满足药用要求;产品生产应建立相应的质量管理体系,并满足制剂的要求;产品配方设计和工艺参数选择应满足产品的特点和预期功能。
预混辅料在生产过程中应对剪切速度等关键工艺参数进行充分验证,并按验证后的工艺参数生产,以确保产品的均一性,尤其应关注配方中较低组分的均一性。共处理辅料应充分评估配方的合理性和工艺条件的科学性,以达到预期功能,且在生产过程中不形成新的化学共价键;应基于单一组分的安全性,结合工艺过程,评估产品的安全性。
应根据配方组成、生产工艺、预期功能以及配方组分中各单一组分的特性等,建立反映产品安全性、功能性与质量均一性的检测项目,其质量研究与控制包括但不限于以下方面:
一、性状 从色泽、外观和溶解性等对产品的性状进行描述。
二、鉴别 采用红外光谱、拉曼光谱、液相色谱等适宜的方法,对配方中的关键组分进行鉴别。
三、检查 应根据产品的配方和工艺,建立检查项目,如干燥失重、水分、残留溶剂、炽灼残渣(或灰分)、重金属(或元素杂质)与有关物质等。对于共处理辅料,若工艺处理后出现了配方中单一组分杂质谱以外的新杂质,应对其进行结构确证,并对其安全性进行充分评估,同时应关注生产过程中可能发生的晶型变化等问题。
四、功能性指标 采用适宜的方法,有针对性地建立适合预期功能的关键功能性检查项目,如色差、肠溶崩解性能、黏度、粒度与粒度分布、流动性等。
五、含量 及功能有效性指标 对于共处理辅料中各组分,以及预混辅料中含量变化可显著影响产品功能性的组分,应尽可能建立有效的分析方法测定其含量或其他反映其功能有效性的指标。
六、微生物限度 必要时,应建立适宜的方法检查产品的微生物限度。限度应符合药用辅料的要求,并满足所应用的制剂要求。
七、稳定性研究 模拟市售包装,选择适宜的考察条件进行稳定性研究,考察内容除化学稳定性与物理稳定性外,应重点关注产品的功能性指标。共处理辅料还需关注晶型(如有)与杂质(包括单一成分控制的杂质及其之外的新杂质)等的变化情况。根据产品特点与稳定性考察结果,选择适宜的包装材料和贮藏条件,以确保产品质量稳定。
中国药用辅料通用名称命名原则中,预混辅料与共处理辅料是对两种或两种以上辅料通过不同处理方式获得的辅料混合物,在命名中应予以体现。
命名原则:
(1)预混辅料一般是多种辅料的简单物理混合物,在中文通用名后加“预混物”,英文名前加“pre-mixed”。通常按用途命名,如薄膜包衣预混物(胃溶型)、薄膜包衣预混物(含乳糖)、薄膜包衣预混物(肠溶型)等。若只有两个组分,采用两个组分的全称叠加,再加预混物,组分叠加顺序根据组分质量比由大到小排序。
(2)共处理辅料不是简单的物理混合物,一般由两个或两个以上辅料共加工处理形成,辅料的物理特性发生了改变但化学特性无明显变化。
中文通用名一般为组分叠加后加“共处理物”,组分叠加次序根据共处理辅料中组分的质量比由大到小排序;当组分比例一致时,根据其英文名首字母次序排序;当组分超过两个时,为避免中文通用名过长,比例在 2%以下的组分可不在名称中体现,但应在来源与定义中描述。
英文名通常为“Co-processed”加组分叠加,应将全部组分列出,每个组分之间用逗号间隔,最后两个组分用 and 相隔。
① 两个组分的共处理辅料,中文通用名以两个组分的全称叠加。如微晶纤维素胶态二氧化硅共处理物(曾用名:硅化微晶纤维素),Co-processed Microcrystalline Cellulose and Colloidal Silicon Dioxide ( 曾 用 名 :Silicified Microcrystalline Cellulose);乳糖聚维酮共处理物,Co-processed Lactose and Povidone。
② 三个或三个组分以上的共处理辅料,中文通用名第一个组分采用全称,之后的组分可采用缩词法,选词见所附缩词表及选词原则 。如 乳 糖 微 晶 淀 粉 共 处 理 物 , Co-processed Lactose,
Microcrystalline Cellulose and Starch(备注:一水乳糖 70%、微晶纤维素 20%、玉米淀粉 10%);乳糖交聚聚维酮共处理物,Co-processed Lactose,Crospovidone and Povidone(备注:一水乳糖93%、交联聚维酮 3.5%、聚维酮 3.5%)。
选词原则:共处理辅料若只有三个组分,第一个组分取全称,第二个组分取 2 个字,第三个组分取 2-3 个字;超过三个成分时,第一个组分取全称,第二至第三组分取 2 个字,第四组分后各取 1 个字,如无特殊规定,一般取中文首字。选词组合的名称应符合常用语言习惯,避免不符合伦理学的组合名称及其他不适宜的情况。
③当共处理辅料的组分相同,比例的次序相同但比例不同时,不同的比例可不在名称中体现,但应在产品的规格和标签标识中加以注明。
数据显示,2020年全球药用辅料市场规模为873亿美元,预计2027年将达到1289亿美元,年复合增长率(CAGR)为5.57%(2021-2027)。中国市场规模增长快速,预计将由2020年的128亿美元增长到2027年的210亿美元,年复合增长率为8.00%(2021-2027)(图3)。然而,2017年我国药用辅料市场规模在整个药品制剂产值中仅为3-5%,国外药用辅料却占整个药品制剂产值的10-20%,表明我国药用辅料市场与国外相比还有较大差距,但目前发展较快,未来前景广阔。

图3. 2020~2027年中国药用辅料市场规模及预测
在固体制剂开发中,共处理辅料的应用给配方及工艺带来了极大的便利。如在直压工艺中,共处理材料的流动性与可压性,大大简化了辅料选择,提高了工艺稳定性,从而节省了制造时间和成本。
连续化生产是固体制剂开发未来的一个趋势。鉴于单一辅料性能的局限,连续化生产工艺现在仍然极具挑战性。但共处理辅料的开发与应用,对于连续化生产中所遇到的流动性、可压性以及均一性问题都带来了极大的改善,使连续化生产工艺变得更简单。
IID中大多数辅料的性质都是从GSRS中提取的。尽管申请人可在原申请中提供辅料的商品名称或通用名称,但IID会显示辅料在GSRS中出现的首选术语,以促进IID中命名的一致性。GSRS首选术语通常用于识别单一成分物质。当美国药典/国家处方集(USP/NF)将辅料确定为单一成分物质时,GSRS首选术语与该辅料的USP/NF专著标题相同。然而,如果USP/NF专著的标题涵盖多种物质,则GSRS对每种成分物质的首选术语可能与该专著有所不同。在这种情况下,IID中的首选术语和USP/NF专论标题可能有所不同。
被USP/NF所收载的共处理辅料和辅料混合物通常在GSRS和IID中保留其专著名称,如果修改了专著标题,则在GSRS和IID中进行更新,以与USP/NF专著保持一致。一个例子是乳化蜡,这是一个具有USP/NF专著的辅料混合物。该辅料以USP/NF名称出现在IID中。如果共处理的辅料或辅料混合物没有USP/NF专著或GSRS首选术语,通常将根据其申请中提供的名称或申请人提供的其他一些唯一标识码在IID中列出。一个例子是辅料油酸甘油酯/丙二醇混合物,它以申请人提供的名称出现在IID中。
未来:
随着药品制剂的研发创新以及质量要求的发展需要,将对药用辅料的有效性、经济性、安全性提出更高的要求,发展以预混与共处理药用辅料为代表的新型辅料势在必行。而随着生物科技、纳米技术、3D 打印等新技术的应用,此类药用辅料的范围和应用会进一步得到扩展,其开发研究具有广阔的市场前景。共处理辅料在弥补药物低机械性能、难溶性、均一性、易成型性等方面展现了显著的技术优势,为粉末直接压片、3D 打印技术等在更多药物制剂的推广应用提供了重要支撑;而这些新药物制剂工艺的发展又能促进新型共处理辅料的研发与应用。
目前随着仿制药一致性评价的常态化,为应对仿制药激烈竞争的挑战,生产制造商在辅料使用环节上降低成本正逐渐成为应对手段之一。而使用可直接压缩的结合剂进行药物生产,不仅可以降低成本,而且在功能上有所增强。使用多功能辅料也是另外一种解决办法,如一些辅料也可以被用作结合剂、崩解剂和稀释剂,由于其具有强大的结合能力,不仅可提高药片的生产量,又可降低成本。而随着技术更新以及业界应用,部分预混与共处理辅料开始被中国药典、美国药典和欧洲药典越来越多的收载,相关指导原则也相继出台。但如何根据不同药物制剂的生产要求,重视和完善预混与共处理辅料的质量标准控制,结合药用辅料本身特性以及药物与辅料相容性等特点[41],开展安全性和功能性风险评估与控制,合理制定质量标准,开展相关检测方法研究,从而保证药物制剂的质量与疗效的一致性,则显得尤为重要。世界各国正作出巨大努力,使药用辅料的标准统一和完善,从而为辅料的快速开发、应用和审批铺平道路。

【收藏】优质药用辅料关联审评推荐——供外用/口服固体制剂应用篇①
