
细菌内毒素这个概念在1890年的时候就已被提了出来,它是在研究发热物质过程所引起的。医药科研人员拿到一份注射用辅料的COA报告或质量标准时,往往最先关注的就是"Endotoxin"(细菌内毒素)检测项目。细菌内毒素标准直接决定原辅料能否用于注射用无菌药品的制备。内毒素超过规定的制剂一旦注射进入人体,将引病患的发热、免疫原性甚至休克等严重不良反应。而内毒素在制剂最后生产过程中难以全部去除,如此要害而又难以根除的“内毒素”,究为何物?
医药研究早期发现,即便是一些消过毒的注射器插入无发热病状的病人体内一段时间后,也可能引起病人出现发热、呕吐等症状,严重时还会导致休克甚至死亡。而在上世纪40年代人类使用青霉素对流行性脑膜炎病人进行治疗时,发现当青霉素大剂量施加于患者后,一些病人出现了休克、死亡。科学家通过研究找到了致命的根源:热原。广义来讲,微量即能引发恒温动物体温异常上升的物质统称为热原,它包括了外因性热原(细菌性热原,化学热原)和内因性热原。而狭义的热原,即为细菌内毒素。
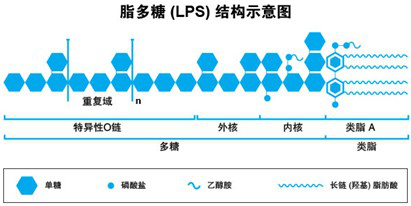
细菌内毒素,英文称作Endotoxin,是G-菌细胞壁个层上的特有结构,内毒素为外源性致热原,它可激活中性粒细胞等,使之释放出一种内源性热原质,作用于体温调节中枢引起发热。细菌内毒素的主要化学成分为脂多糖。脂多糖只有当细菌死亡溶解或用人工方法破坏菌细胞后才释放出来,所以叫做内毒素(相对细菌分泌的毒素称为外毒素)。内毒素为外因性热原,它可以激活机体中性粒细胞使之释放出一种内因性热原质,作用于体温调节中枢而引起病患的发热。内毒素分子由菌体特异性多糖、非特异性核心多糖和类脂质A三部分构成,类脂质A是内毒素的主要毒性组分。欧洲药典委员会副主席J.Van Noordwijk提出:“严格地讲,不是每一种热原都具有脂多糖的结构,但所有已知的细菌内毒素脂多糖都有热原活性”。
不同革兰氏阴性细菌的类脂质A结构基本相似。因此,凡是由革兰氏阴性菌引起的感染,虽菌种不一,其内毒素导致的毒性效应大致类同。
这些毒性反主要有:
一、发热反应
人体对细菌内毒素极为敏感。极微量(1-5纳克/公斤体重)内毒素就能引起体温上升,发热反应持续约4小时后逐渐消退。感染时,因革兰氏阴性菌不断生长繁殖,同时伴有陆续死亡、释出内毒素,故发热反应将持续至体内病原菌完全消灭为止。
二、白细胞反应
细菌内毒素进入宿主体内以后,血液中占白细胞总数60-70%的中性粒细胞数量迅速减少,1-2小时后,由内毒素诱生的中性细胞释放因子刺激骨髓释放其中的中性粒细胞进入血液,使其数量显著增加;内毒素引起血中各种细胞的损伤,各种炎症介质释放,炎症反应启动。
三、内毒素休克
当病灶或血流中革兰氏阴性病原菌大量死亡,释放出来的大量内毒素进入血液时,可发生内毒素血症。大量内毒素作用于机体的细胞、血小板,补体系统和凝血系统等,便会产生白细胞介素等生物活性物质。这些物质作用于小血管造成功能紊乱而导致微循环障碍,临床表现为微循环衰竭、低血压、缺氧、酸中毒等,于是导致病人休克,这种病理反应叫做内毒素休克。上文的青霉素大量使用致死,就是因为大剂量青霉素一下子将全部脑膜炎病菌杀死,使大量内毒素一次放出,促成了内毒素休克,加速了患者的死亡。
由于当细菌死亡或自溶后便会释放出内毒素,细菌内毒素广泛存在于环境中。内毒素不是蛋白质,为糖类和脂类物质的复合物,所以非常耐热:在100℃的高温下加热1小时也不会被破坏,只有在160℃以上温度下加热2到4个小时;或用强碱、强酸或强氧化剂加温煮沸30分钟才能破坏它的生物活性。与外毒素不同之处还在于:内毒素不能被稀甲醛等溶剂脱去毒性成为类毒素,只会降解成更小的物质,并仍然具有热原性。所以注射剂辅料中一旦被内毒素污染,去除将十分困难。由此可见,而对辅料的生产过程中微生物和内毒素的控制尤为重要,制剂辅料的内毒素控制中,对注射用水、原料、工器具及其包材、容器及密封系统和人员操作中都进行严格要求,良好的GMP生产条件是注射剂辅料内毒素控制的重要保证之一。
当一种辅料需要被用于注射用制剂的生产时,其COA报告中必须对内毒素指标有明确限制。生物制品类、注射用药剂、化学药品类、放射性药物、抗生素类、疫苗类、透析液等制剂辅料必须经过细菌内毒素检测试验合格后才能使用。符合相关药典注射用标准的药用辅料,称之为“注射级”(Parenteral Grade)。对于非注射级别的辅料应质量严格控制,使用慎之又慎:一般的医药级辅料如没有对内毒素注明标准,是不可以用于注射制剂的生产的; 对于生产商注明有注射使用依据,但尚未用于注射用标准产品生产的辅料,应关注其精制工艺、内控注射用标准依据及标准,必要时应关注其相关安全性试验资料。
虽然一些医药级别的辅料也可对内毒素有相关控制(国内一般采取使用0.1%活性炭吸附除去辅料中的热原的方法,达到控制内毒素的目的);或制剂生产者可以对其进行再加工除去内毒素(如使用5K超滤膜去除内毒素),在此还是建议注射用制剂使用符合相关药典的高品质注射级辅料,并且生产过程符合辅料生产GMP厂房中进行,以最大程度保证注射剂用辅料的使用安全性。